Постулаты бора и квантование орбит. Уровни энергии (атомные, молекулярные, ядерные)
В нерелятивистском приближении стационарные состояния атома определяются уравнением Шредингера для системы электронов, движущихся в кулоновом поле ядра и электрически взаимодействующих друг с другом; в это уравнение вовсе не входят операторы спина электронов. Как мы знаем, для системы частиц в центрально-симметричном внешнем поле сохраняется полный орбитальный момент L, а также четность состояния. Поэтому каждое стационарное состояние атома будет характеризоваться определенным значением момента L а своей четностью. Кроме того, координатные волновые функции стационарных состояний ристемы одинаковых частиц обладают определенной перестановочной симметрией. Мы видели в § 63, что для системы электронов каждому определенному типу перестановочной симметрии (т. е. определенной юнговской схеме) соответствует определенное значение полного спина системы. Поэтому каждое стационарное состояние атома будет характеризоваться также и полным спином S электронов.
Энергетический уровень с заданными значениями S и L вырожден соответственно различным возможным направлениям векторов S и L в пространстве. Кратность вырождения по направлениям L и S равна соответственно . Всего, следовательно, кратность вырождения уровня с заданными L и S равна произведению .
В действительности, однако, в электромагнитном взаимодействии электронов существуют релятивистские эффекты, зависящие от их спинов. Они приводят к тому, что энергия атома оказывается зависящей не только от величины векторов L и S, но и от их взаимного расположения. Строго говоря, при учете релятивистских взаимодействий орбитальный момент L и спин S атома уже не сохраняются каждый по отдельности. Остается лишь закон сохранения полного момента являющийся универсальным точным законом, следующим из изотропии пространства по отношению к замкнутой системе. Поэтому точные уровни энергии должны характеризоваться значениями J полного момента.
Однако если релятивистские эффекты относительно малы (как это часто имеет место), то их можно учесть в качестве возмущения.
Под влиянием этого возмущения вырожденный уровень с заданными L a S «расщепляется» на ряд различных (близких друг к другу) уровней, отличающихся значениями полного момента .
Эти уровни определяются (в первом приближении) соответствующим секулярным уравнением (§ 39), а их волновые функции (нулевого приближения) представляют собой определенные линейные комбинации волновых функций исходного вырожденного уровня с данными L и
В этом приближении можно, следовательно, по-прежнему считать абсолютные величины орбитального момента и спина (но не их направления) сохраняющимися и характеризовать уровни также и значениями L и
Таким образом, в результате релятивистских эффектов уровень с данными значениями L и S расщепляется на ряд уровней с различными значениями J. Об этом расщеплении говорят как о тонкой структуре (или мультиплетном расщеплении) уровня. Как мы знаем, J пробегает значения от L + S до поэтому уровень с данными L a S расщепляется на (если ) или (если ) различных уровней. Каждый из этих уровней остается вырожденным по направлениям вектора J; кратность этого вырождения равна . Легко проверить, что сумма чисел со всеми возможными значениями J равна, как и должно было быть, ).
Атомные уровни энергии (или, как говорят, спектральные термы атомов) принято обозначать символами, аналогичными тем, которые используются для обозначения состояний отдельных частиц с определенными значениями момента (§ 32). Именно, состояния с различными значениями полного орбитального момента L обозначаются большими буквами латинского алфавита со следующим соответствием:
Слева вверху от символа указывается число , называемое мультиплетностью терма (надо, однако, помнить, что это число совпадает с числом компонент тонкой структуры уровня лишь при ) Справа внизу указывается значение полного момента J. Так, символы обозначают уровни с .
Постулаты Бора и квантование орбит
Успех в устранении этих противоречий был достигнут Нильсом Бором в 1913 г., когда он распространил идеи Планка и Эйнштейна о квантовых свойствах электромагнитного излучения и на атомы вещества. Бор ограничился рассмотрением атома водорода, поскольку он очень прост (единственный электрон вращается вокруг одного протона) и поддается математическому анализу.
Изучая линейчатый спектр атома, Бор понял, что существуют очень простые правила, управляющие излучением световых волн атомами вещества, которые хорошо объясняют множество существующих электронных орбит. Свои выводы онсформулировал в виде известных постулатов Бора.
Первый постулат Бора (постулат стационарных состояний): электроны в атоме могут обладать лишь определенными (разрешенными) значениями энергии, другими словами - находиться на определенных энергетических уровнях , образующих дискретный энергетический спектр атома.
Второй постулат Бора (правило частот): при определенных условиях электроны могут переходить с одного уровня на другой (или с одной орбиты на другую), поглощая или испуская фотон.Существует орбита с наименьшей возможной энергией, на которой электрон может находиться неограниченно долго
это его основное состояние . При переходе с низшего энергети ческого уровня на высший электрон возбуждается, но при каждом удобном случае всегда стремиться вернуться из возбужденного состояния обратно в основное. В возбужденном состоянии электрон может находиться не дольше наносекунды.
Рис 30. Энергетическая схема атомных уровней. Энергия Е1 соответствует
основному состоянию, Е2 – возбужденному.
Что же заставляет электрон постоянно стремиться к своему первоначальному состоянию? Читатели наверняка обращали внимание, что большинство всех объектов в природе всегда стремится минимизировать любое напряжение. Так, например, капля жидкости принимает сферическую, а не треугольную или квадратную форму именно потому, что такая форма наиболее “выгодна” с точки зрения противостояния силам поверхностного натяжения. То же самое справедливо и для электрона: чтобы удержаться на верхней орбитали (превосходящей по энергии его собственную), ему нужно изрядно “попотеть”, преодолевая мощную силу притяжения ядра – а какому нормальному электрону это понравится? В этом смысле электрон можно в шутку сравнить с лентяем в спортзале: едва тренеру удастся загнать его на высокую перекладину, он вместо того, чтобы подтягиваться, тут же норовит c нее спрыгнуть.
“А как же тогда электрон переходит на более высокий уровень?”, – спросите вы. Предположим, что атом находится в состоянии n и обладает энергией En . Чтобы вынудить электрон перейти на уровень m, мы должны каким_то образом “выпихнуть” его из основного состояния, придав ему некоторую дополнительную энергию (подобно тому, как пинок тренера необходим, для того,чтобы лодырь оказался на перекладине). Для этого будем “обстреливать” электрон световыми фотонами различной частоты. Напоминаем, что энергия фотона зависит от частоты излучения, поэтому она равна:
Е=ћ _
где _ –частота,
ћ –постоянная Планка.
Оказывается, не каждый фотон способен вынудить атомперейти в возбужденное состояние, а лишь тот, чья энергия в точности равна разности энергий возбужденного и основного состояний электрона в атоме, то есть:
ћ _ =Еm*En
Только при такой энергии электрон, поглотив фотон, перейдет на уровень, соответствующий энергии Еm .
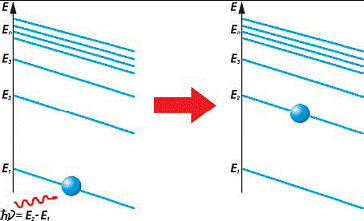
Рис 31. Получив необходимое количество энергии, электрон переходит на следующий
энергетический уровень
Если же энергия фотона окажется больше либо меньше необходимой, то он “пролетит” сквозь атом, никоим образом не повлияв на состояние электрона.
Итак, электрон находится в возбужденном состоянии, из которого он в силу своей природы стремится вернуться обратно на “родной” уровень. Для этого ему нужно “освободиться” от энергии, полученной от фотона. Поэтому обратный переход сопровождается испусканием светового фотона абсолютно той
же частоты, то есть
Еn=Em*ћ _
Так квантовая механика обнаружила, что атом обладает способностью поглощать и испускать фотоны света , и это в дальнейшем послужило основой создания лазеров и множества других машин, использующих этот принцип. Итак, сформулируем важный вывод из теории квантовой механики: физические величины в квантовом мире изменяются квантами, т.е. дискретно .
Невозможно представить себе квантовую физику без одного из ее основных принципов:
|
Принцип Паули (или принцип запрета): на каждом энергетическом уровне атома в данном состоянии может находиться только один электрон, при этом чем выше уровень электрона, тем большая энергия ему соответствует. Каждому значению энергии соответствует своя орбита электрона вокруг ядра. |
Состояние электрона в атоме характеризуется четырьмя квантовыми числами. Главное квантовое число n определяет энергию электрона в атоме и размер АО, т.е. удаленность электрона от ядра. Главное квантовое число n принимает значения целых чисел 1, 2, 3, 4… Совокупность электронов с одинаковым значением n называется энергетическим уровнем. Наименьшей энергией обладают электроны первого от ядра энергетического уровня (n=1); с увеличением n энергия электрона и его удаленность от ядра возрастает. Состояние атома, когда его электроны находятся на таких энергетических уровнях, что их суммарная энергия является минимальной, называется основным или невозбужденным. Состояния с более высокими значениями энергии называются возбужденными. Энергетические уровни обозначают буквами:
Числовое значение n 1 2 3 4 5 6 7
Буквенное обозначение K L M N O P Q
Число энергетических уровней в атоме, находящемся в основном состоянии, равно номеру периода, в котором находится элемент.
На одном и том же энергетическом уровне могут находиться атомные орбитали различной формы, отличающиеся друг от друга по энергии. Поэтому энергетические уровни разделяются на подуровни. Энергию электрона на подуровне и форму атомной орбитали характеризует орбитальное квантовое число l . Значение l зависит от главного квантового числа: l принимает значения от 0 до (n–1), т. е. 0, 1, 2, 3… (n–1). В пределах данного энергетического уровня совокупность электронов, характеризующихся одинаковым значением l , называется энергетическим подуровнем. Подуровни обозначают буквами:
Орбитальное квантовое число l 0 1 2 3
Обозначение энергетического подуровня s p d f
Таким образом, при l = 0, 1, 2, 3 электроны находятся соответственно на s-, p-, d-, f-подуровнях. Электроны различных подуровней называют s-, p-, d-, f-электронами. В этом случае говорят также о состояниях s-, p-, d-, f-электронов или s-, p-, d-, f-атомных орбиталях.
18. Главное квантовое число.
Главное квантовое число - это целое число, которое является определением состояния электрона на энергетическом уровне. Энергетический уровень – это набор стационарных состояний электрона в атоме с близкими значениями энергии. Главное квантовое число определяет удаленность электрона от ядра, и характеризует энергию электронов, которые этот уровень занимают.
19. Орбитальное квантовое число. Формы электронных облаков
Орбитальное квантовое число - в квантовой физике квантовое число ℓ, определяющее форму распределения амплитуды волновой функции электрона в атоме, то есть форму электронного облака. Определяет подуровеньэнергетического уровня, задаваемого главным (радиальным) квантовым числом n и может принимать значения
Является собственным значением оператора орбитального момента электрона, отличающегося от момента количества движения электрона j лишь на оператор спина s :
Разность орбитального квантового числа и квантового числа полного момента не превосходит, по абсолютной величине, (спин электрона). Азимутальное квантовое число определяет ориентацию электронного облака в пространстве.
Согласно механистической модели форма электронного облака атома является следствием формы ядра атома. Источниками сил, связывающих атомы друг с другом, являются зоны перекрытия электронных облаков. Зоны перекрытия одновременно являются частью электронных облаков обоих соприкасающихся атомов. Чем больше зон перекрытия, тем крепче связь между атомами. Каждый электрон электронного облака на большей части своей траектории взаимодействует преимущественно с одним из протонов ядра, формируя часть электронного облака – электронный лепесток. Но в зонах перекрытия электроны могут переходить из одного электронного лепестка в другой. Электронные лепестки, связанные с протонами законченной ядерной оболочки в межатомных связях не участвуют. Они сливаются в сплошное электронное облако, границы которого намного ближе к центру ядра, чем концы обособленных электронных лепестков. По этой причине сплошное электронное облако не достает до электронных облаков соседних атомов и не способно создавать с ними зоны перекрытия. Межатомные связи способны создавать только обособленные электронные лепестки. Они вытягиваются далеко за пределы сплошных электронных облаков и притягиваются к подобным электронным лепесткам других атомов, создавая зоны перекрытия. Притяжение атомов происходит до достижения баланса между гравидинамическими силами притяжения и силами упругости электронной оболочки. Из этого следует, что границы электронного облака атома не являются жестко фиксированными и могут меняться при изменении плотности атомов. Соответственно, могут меняться и размеры атома. Попробуем построить теоретически возможные конфигурации зон перекрытий между электронными облаками идентичных атомных изомеров при максимальной упаковке. Такие слипшиеся однотипные атомы способны образовывать монокристалл – объемную гигантскую молекулу с периодичной структурой.
Предположим, что схема нижних энергетических уровней атомов некоего элемента имеет вид, показанный на рисунке, и атомы находятся в состоянии с энергией Электрон, столкнувшись с одним из таких покоящихся атомов, в результате столкновения получил некоторую дополнительную энергию. Импульс электрона после столкновения с атомом оказался равным Определите кинетическую энергию электрона до столкновения. Возможностью испускания света атомом при столкновении с электроном пренебречь. Эффектом отдачи пренебречь.
Решение.
Если при столкновении с атомом электрон приобрел энергию, то атом перешел в состояние Следовательно, после столкновения кинетическая энергия электрона стала равной где — энергия электрона до столкновения; отсюда: Импульс p электрона связан с его кинетической энергией соотношением или где m — масса электрона.
Следовательно,
Гость
18.05.2012 17:00
Объясните пожалуйста, почему электрон перешёл в состояние Е(0) и почему эту энергию (3,5 эВ) мы прибавляем к энергии электрона?
Гость
Добрый день!
По постулатам Бора, атом может находиться только в строго определенных состояниях. При столкновении атома и электрона выполняется закон сохранения энергии. По условию, энергия электрона увеличилась, а значит, энергия атома должна была уменьшиться. Так как атом находится на первом энергетическом уровне, единственный способ для него уменьшить свою энергию - перейти на нулевой уровень. При этом его энергия уменьшается на Поскольку вероятностью излучения можно пренебречь, согласно условию, а величиной кинетической энергии отдачи ядра пренебречь в силу ее малости, заключаем, что вся эта энергия передается электрону.
Виталий
22.03.2016 07:54
Здравствуйте!
В задаче 3045 по физике есть несколько вопросов:
1) Правильно ли я понимаю, что в системе опосредованно говорится о 2-ух электронах? Один - в поле центральных сил ядра. Второй - свободный электрон пролетающий мимо атома и условно с ядром не взаимодействующий никогда, а с «атомным» электроном – только в момент передачи импульса?
2) Если на первый вопрос ответ "да", то схема "энергетических уровней атома" - это допустимые уровни энергий связанного, «атомного», электрона?
3) Правильно ли, что подлетающий электрон находится на уровне E(бесконечность) или выше?
4) Пролетающий электрон провзаимодействовав с эл. в атоме не был захвачен? Он улетает с ещё большей энергией?
5) К какому типу энергии можно отнести энергию пролетающего электрона (кинетическая и т.д.) в момент его подлёта к атому?
После ответов на эти вопросы я смогу определиться есть в задаче ошибка или нет. Извините что пишу здесь, в КНР есть проблемы с доступом в VK.
Антон
1) Нет, в задаче говорится об атоме и свободном электроне.
2) В данной задаче не нужно рассматривать вклады электронов атома и его ядра в энергетические уровни атома. Атом рассматривается как единый объект с заданным спектром энергий.
3) Свободный электрон не является частью атома, не корректно его энергию помещать на схему энергетических уровней атома (его энергию можно изобразить рядом). Если говорить о возможном спектре кинетических энергий свободного электрона, то он континуальный (не дискретный): В данной задаче кинетическая энергия свободного электрона до столкновения была 1,45 эВ, и 4,95 эВ после.
4) Электрон взаимодействовал с атомом в целом и получил от него порцию энергии.
5) Кинетическая.
Для электрона, находящегося под действием сил притяжения к ядру, уравнение Шредингера имеет решения не при любых, а только при определенных значениях энергии. Таким образом, квантованность энергетических состояний электрона в атоме (т. е. первый постулат Бора) оказывается следствием присущих электрону волновых свойств и не требует введения особых постулатов.
Для лучшего понимания последнего утверждения рассмотрим упрощенную модель атома, «одномерный атом», в котором электрон может совершать лишь колебательные движения между крайними точками.
Будем считать также, что границы атома непроницаемы для электрона, так что он может находиться только внутри атома. Мы уже знаем, что состояние электрона в атоме характеризуется некоторой волной («волна де Бройля»). Но было бы неправильно представлять себе распространение этой волны как нечто подобное движению волны, образовавшейся на поверхности воды от брошенного камня: водяная волна неограниченно удаляется от места своего образования и постепенно расплывается, она не обладает устойчивостью во времени, тогда как электрон в атоме устойчив. Поэтому более правильной будет аналогия между состоянием электрона в атоме и состоянием звучащей струны, на которой образуются так называемые стоячие волны.
На рис. 6 схематически изображены стоячие волны, возникающие на колеблющейся струне, крайние точки которой закреплены. В точках, обозначенных буквой n, возникают пучности - здесь амплитуда колебания максимальна, в точках у струна не колеблется - это узлы, в которых амплитуда колебания равна нулю; в точках, расположенных между узлами и пучностями, амплитуда колебания имеет промежуточные значения. Поскольку конечные точки струны закреплены, здесь обязательно возникают узлы. В отличие от обычной «бегущей» волны, стоячая волна не перемещается в пространстве и не переносит энергии, которая лишь передается от одних точек струны к другим. Нетрудно видеть (рис. 6), что на струне с закрепленными концами длина стоячей волны может быть не любой, а только такой, чтобы на всей струне укладывалось целое число полуволн: одна (рис. 6, а), две (рис. 6,б), три (рис. 6, в) и т. д.
В рассматриваемой одномерной модели атома волна де Бройля тоже должна быть стоячей: это следует из того, что выйти за границы атома электрон не может и, следовательно, на границах атома волновая функция (т. е. амплитуда волны) должна обращаться в нуль. Поэтому рис. 6 может рассматриваться как модель одномерного атома со стоячими волнами де Бройля, которые могут в этом атоме образоваться.
Если длина одномерного атома равна l, то для случаев а, б и в на рис. 6 длина волны де Бройля будет выражаться следующим образом:
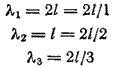
Следовательно, стоячая волна может образоваться только при условии
где , т. е. целое число.
Рис. 6. Стоячие волны на струне.
С другой стороны, согласно уравнению де Бройля
Приравнивая правые части двух последних уравнений, получим для скорости электрона выражение:
Теперь, зная скорость электрона , можно найти его кинетическую энергию Е:
Поскольку n - целое число, то последнее выражение показывает, что энергия электрона в одномерном атоме не может иметь произвольные значения: при n=1 она равна величине дроби , при n=2 она в 4 раза больше, при n=3 - в 9 раз больше и т. д. Таким образом, в случае одномерного атома волновые свойства электрона, выражаемые уравнением де Бройля, действительно имеют следствием квантованность энергетических состояний электрона. При этом допустимые уровни энергии электрона определяются значением целого числа n, получившего название квантового числа.
Разумеется, найденное выражение для энергии электрона относится к упрощенной модели атома. Но и для реального атома решение уравнения Шредингера также приводит к выводу о квантованности энергетических состояний электрона в атоме.
Модель одномерного атома позволяет понять, почему электрон, находящийся в атоме в стационарном состоянии, не излучает электромагнитной энергии (второй постулат теории Бора). Согласно модели Бора-Резерфорда, электрон в атоме совершал непрерывное движение с ускорением, т. е. все время менял свое состояние; в соответствии с требованиями электродинамики, он должен при этом излучать энергию. В одномерной модели атома стационарное состояние характеризуется образованием стоячей волны де Бройля; пока длина этой волны сохраняется постоянной, остается неизменным и состояние электрона, так что никакого излучения происходить не должно.
Становится ясным и вопрос о состоянии электрона при переходе из одного стационарного состояния в другое (в терминологии Бора - с одной стационарной орбиты на другую). Если, например, электрон из состояния, отвечающего рис. 6, а, переходит в состояние, соответствующее рис. 6,б, то во время этого перехода длина волны де Бройля будет иметь переменное значение, не отвечающее условию образования стоячей волны. Именно поэтому состояние электрона в этот промежуток времени будет неустойчивым; оно будет меняться до тех пор, пока длина волны де Бройля не будет вновь соответствовать условию образования стоячей волны, т. е. пока электрон не окажется в новом стационарном состоянии.
В упрощенной одномерной модели атома положение электрона относительно ядра определяется одной координатой, а его состояние- значением одного квантового числа. В двумерной (плоской) модели атома положение электрона определяется двумя координатами; в соответствии с этим, его состояние характеризуется значениями двух квантовых чисел. Аналогично в трехмерной (объемной) модели атома состояние электрона определяется значениями трех квантовых чисел. Наконец, изучение свойств электронов, входящих в состав реальных атомов, показало, что электрон обладает еще одной квантованной физической характеристикой (так называемый спин, см. § 30), не связанной с пространственным положением электрона. Таким образом, для полного описания состояния электрона в реальном атоме необходимо указать значения четырех квантовых чисел.
28. Главное квантовое число. Итак, в одномерной модели атома энергия электрона может принимать только определенные значения, иначе говоря - она квантована. Энергия электрона в реальном атоме также величина квантованная. Возможные энергетические состояния электрона в атоме определяются величиной главного квантового числа n, которое может принимать положительные целочисленные значения: 1, 2,... и т. д. Наименьшей энергией электрон обладает при n=1 с увеличением n энергия электрона возрастает. Поэтому состояние электрона, характеризующееся определенным значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме: при n=1 электрон находится на первом энергетическом уровне, при n=2 - на втором и т. д.
Главное квантовое число определяет и размеры электронного облака. Для того чтобы увеличить размеры электронного облака, нужно часть его удалить на большее расстояние от ядра. Этому препятствуют силы электростатического притяжения электрона к ядру, преодоление которых требует затраты энергии. Поэтому большим размерам электронного облака соответствует более высокая энергия электрона в атоме и, следовательно, большее значение главного квантового числа n. Электроны же, характеризующиеся одним и тем же значением главного квантового числа, образуют в атоме электронные облака приблизительно одинаковых размеров; поэтому можно говорить о существовании в атоме электронных слоев или электронных оболочек, отвечающих определенным значениям главного квантового числа.
Для энергетических уровней электрона в атоме (т. е. для электронных слоев, или оболочек), соответствующих различным значениям n, приняты следующие буквенные обозначения.
